目前氢气-甲烷两相厌氧发酵在其他厌氧发酵领域已有广泛应用,但煤制生物氢-甲烷两相厌氧发酵成果相对较少。单相厌氧产氢技术效率低下,生成的大量挥发性脂肪酸未被及时有效利用导致底物降解率低、经济成本增加[1]。两相厌氧消化系统的产甲烷活性明显高于单相厌氧消化系统,甲烷产量大约可提高20%,在处理有机垃圾过程中挥发性固体降解率可达80%,产气量达到了理论产气量的98%[2-4]。苏现波[5]等以煤为发酵底物分析了连续发酵产氢产甲烷的最佳产气条件,发现氢气-甲烷联产工艺有利于煤的资源化利用,可明显提升其能源转化率。
煤发酵联产氢气-甲烷过程中液相产物变化特征研究对于联产系统的稳定运行、产气效率的提高具有重要意义。鉴于此,笔者以义马煤田长焰煤作为产氢发酵降解底物,在最佳环境因子水平下进行生物发酵制氢实验;产氢结束后,向同一反应装置内加入新制煤样和产甲烷菌液,以产氢发酵液为混合底物进行甲烷联产实验,以期为煤层生物气资源开发提供借鉴。
1 实验材料与方法
1.1 样品准备
实验所用煤样采自河南义马千秋矿,经钻孔取芯后置于氩气填充密封的无菌玻璃罐内储存备用,煤阶为长焰煤,煤质分析见表1。
表1 实验所用煤样的煤质分析
Table 1 Coal quality analysis %

工业分析MadAadVadFCad元素分析CdafHdafNdafSdaf10.455.3231.1553.0876.245.291.0817.39
1.2 实验方案
在严格缺氧和无菌条件下进行煤发酵联产氢气-甲烷实验。采用义马煤层矿井水作为菌种来源,在井下采煤工作面涌水口处人工采集新鲜水样,运往实验室后冲入氩气以尽可能保证其厌氧条件,并将其放置在实验室冰箱内密封保存。反应模拟装置如图1所示。

图1 联产生物反应器模拟装置
Fig.1 Experimental simulation device of cogeneration bioreactor
分别配制1 000 mL产氢培养基(NH4Cl,1.0 g;MgCl2·6H2O,0.1 g;K2HPO4·3H2O,0.4 g;NaCl,2.0 g;酵母膏,1.0 g;刃天青,0.001 g;L-半胱氨酸盐酸盐,0.5 g;NaHCO3,2.0 g;胰蛋白胨,1.0 g;C6H12O6,10.0 g;微量元素液10 mL和矿井水1 000 mL)与产甲烷培养基(NH4Cl,1.0 g;MgCl2·6H2O,0.1 g;K2HPO4·3H2O,0.4 g;KH2PO4,0.2 g;酵母膏,1.0 g;刃天青,0.001 g;L-半胱氨酸盐酸盐,0.5 g;Na2S,0.2 g;NaHCO3,2.0 g;乙酸钠,2.0 g;甲酸钠,2.0 g;胰蛋白胨,0.1 g;微量元素液10 mL和矿井水1 000 mL),在35 ℃恒温条件下厌氧培养4~5 d,得到富集程度较高的产氢、产甲烷菌液。
富集培养完成后向富含产氢菌的培养瓶加入约100 g,粒度为100~200 μm新鲜煤样并用橡胶塞和锡箔纸封盖密封。产氢结束后,保留煤颗粒沉淀物并用KOH标准溶液中和产氢发酵液,同时向产氢装置内加入同质量、同粒度的煤样及同体积的产甲烷富集液,轻轻摇晃至混合均匀,在产氢模拟装置基础之上形成产甲烷发酵模拟装置。
1.3 分析方法
使用配备有Agilent J&W GS-CarbonPLOT色谱柱(60 μm×320 μm×1.5 μm)与200 ℃热导检测器的Agilent 7890 GC气相色谱仪,基于色谱峰面积定量计算气体产气量。产气量单位用μmol/g代替mL/g。
发酵液经0.45 μm滤膜过滤,采用30 mL二氯甲烷分3次萃取得到挥发性中间产物并运用气相色谱-质谱联用仪(GC-MS)分析煤发酵联产氢气-甲烷过程液相有机产物成分。
2 结果与讨论
2.1 氢气、甲烷产气量分析
根据产气速率快慢,每隔一段时间测试氢气和甲烷的气体组分,分析数据如下。
如图2(a)所示,产氢初期第3天出现第1次产氢峰值66.29 μmol/g,约占产氢总量的25.78%,并伴有产氢菌群的生长代谢[6],第4天时氢气产气量降至16.45 μmol/g,第5天时出现第2次产氢峰值51.94 μmol/g,5 d后产气量开始下降,7 d时几乎不产气,遂终止实验。产氢结束后的煤质量为97.6 g,减少了2.4 g,转化率达2.4%。实验周期内生物产气量与H2产气量变化基本一致。

图2 氢气、甲烷模拟产气量历史曲线
Fig.2 Gas production history curves of H2 and CH4
产氢结束后甲烷的生成出现一定的延缓期(图2(b)),前6 d为甲烷生成衔接过渡阶段,几乎没有甲烷产生或浓度过低而无法被检测到。6~8 d CH4产率非常低,占甲烷总产气量的4.33%,并伴随有若干水解菌和产甲烷菌的生长[6]。第9天出现第1个产甲烷高峰期15.41 μmol/g,第16 d出现第2个产甲烷高峰期55.78 μmol/g,分别占甲烷总产气量的7.04%和25.47%,17 d后甲烷产量变化不大直至实验结束。联产甲烷结束后煤质量减少了9.8 g,转化率达4.9%。
氮气在氢气-甲烷联产过程中仍有少量的生成和消耗且与酰胺类液相产物的变化特征相关联,但并不作为气体产物分析的重点对象。
2.2 发酵液关键液相指标分析
有机中间体的变化控制着气体的浓度和其他液相指标的变化,是培养时间的函数。因此,在本次煤发酵联产氢气-甲烷过程中结合液相产物的具体变化对发酵液内关键液相指标进行了分析。
煤是一种微溶于水的大分子有机混合物,外源菌的添加降解可使煤中脂肪烃、小分子芳香烃等可溶性有机质增加,这些变化会体现在化学需氧量(COD)值的变化上[7]。产氢发酵液COD在7 d内逐渐升高,在第2~4天内速率发生变化(图3(a)),第6天COD浓度出现反应时间段中的最大值857.82 mg/L。产氢初期大分子物质被水解菌、细菌降解并转化成烷烃、氨基酸、酚、酸、醇等有机小分子物质,产氢高峰期液相内直链烷烃、支链烷烃,醇类等有机物含量的增加导致该时期COD变化速率增加。
产氢阶段pH处于一个合适的范围内[8],pH呈现出先增加后降低又增加的趋势,而液相浊度(OD600)一直增加直到第4天,之后开始趋于下降。检测分析发现,第2~4天内发酵液内并没有酸性有机物的大量积累,而丁醇、八角甾醇、酰胺类有机物含量较高导致其pH值较大(图4);产氢末期(4~6 d),丙酸、丁酸的积累加上气体产物CO2的溶解、酰胺类有机物的降解,导致其pH值开始降低。OD600与菌的数量有关,后期酸化现象的产生会引起菌活性的降低及部分死亡,导致OD600值降低。

图3 氢气、甲烷发酵液关键指标变化
Fig.3 Change of key indexes in fermentative liquid

图4 产氢过程液相有机物总离子色谱及浓度变化
Fig.4 Total ion current chromatograms of liquid organic compounds and relative concentration in fermentation hydrogen production
甲烷液相指标在21 d发酵期内COD变化趋势明显,pH,OD600维持在一个相对较为稳定的范围内(图3(b))。产甲烷水解阶段是发酵过程的速率决定步骤,水解完成后产生大量的小分子有机化合物(包括碱性物质二甲胺等,图5),导致COD和pH增加[9]。第6~9天,煤中小分子被产酸细菌和产甲烷菌降解产生挥发性脂肪酸、CH4和CO2(图2(b),图6(b)),导致COD降低,同时酸性物质的积累使pH略有下降,但最终酸碱保持相对平衡。COD,pH值变化与菌浊密切相关。发酵初期,煤充足的降解底物为菌群的生长代谢提供了良好的物质基础,OD600浓度相对较高,但随着发酵时间的延长,酸性或有毒物质的积累影响了菌体的代谢活性,使OD600开始逐渐降低,而发酵末期微生物的自我调节又使得OD600又有小幅度的增加[7]。
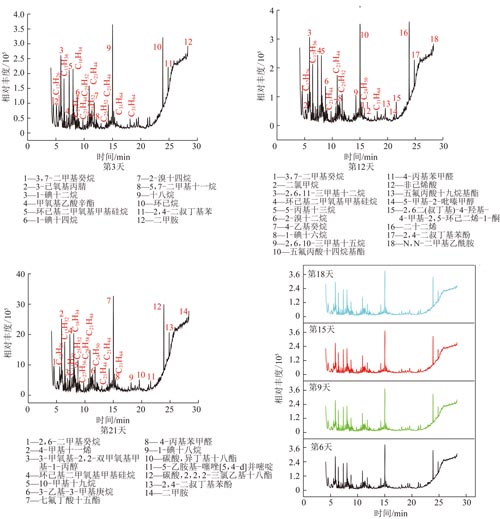
图5 产甲烷过程液相有机物总离子色谱
Fig.5 Total ion current chromatograms of liquid organic compounds in fermentation methane production

图6 产甲烷过程不同类型有机物浓度变化
Fig.6 Relative concentration of different organic compounds in fermentation methane production
2.3 液相产物变化特征
目标气相产物氢气或甲烷的生成,与发酵期间有机液相产物的生成、消耗、转化有着密切的联系。基于此,定性测定了反应模拟装置内不同时段有机中间体。为使实验结果更具可靠性和直观性,除了内标样品外,基于不同有机化合物的峰面积与内标峰面积成正比的特性,对其余有机中间体的变化程度进行了半定量分析。
2.3.1 产氢液相产物
如图4所示,产氢发酵液内积累了不同类型与浓度的有机物,较好的解释了产氢发酵液内pH,COD等液相指标变化的内在原因。
产氢初期,微生物菌群对煤中桥键破坏强度较弱,苯酚等大分子有机物无法被降解[10],因而只生成了少量的烷烃、丁醇、2-甲基丙酸、丁酸、五氟丙酸十九烷基酯、二甲胺等有机物。
随着产氢菌的不断繁殖代谢,OD600不断增大,菌浊增加,加大了对煤结构中桥键破坏强度,并使得COD也逐渐增加;煤中糖类物质通过酵解途径转化为丙酮酸,在丙酮酸铁氧还蛋白酶的作用下发生脱羧反应并结合到酶焦磷酸硫胺素上生成乙酰CoA并与NADH结合生成乙酸、丁酸等物质[11]。另一方面,丙酮酸在相关生物酶的作用下进一步转化为α-乙酰乳酸、3-羟基-2-丁酮,最终生成2,3-丁二醇[11-13]。这一转化结果使得直链、支链烷烃有机物、丁醇、酮类及酚类物质产量增加,并新生成正十六、二十六、二十五等直链烷烃,2-溴十四烷、2,6,11-三甲基十二烷等支链烷烃,八角甾醇有机物,同时检测到含量较低的2,4-二叔丁基苯酚、5-乙胺基-噻唑[5,4-d]并嘧啶等大分子有机物。该时期反应器内各类微生物菌群、物质的消耗与产生处于相对均衡状态,并未导致发酵液内酸性有机物的大量积累(图4);第6~7天,在产乙酸菌作用下氢气的积累导致氢分压过高抑制反应正向进行,同时发酵末期有机负荷的提高也往往会导致丙酸的产生和积累[14],导致产氢模拟装置内产生酸化现象,pH降低。
2.3.2 产甲烷液相产物
不同液相有机中间产物在产甲烷模拟装置内积累,且呈现出一些新的变化特征(图5,6)。
甲烷生成第3~9天,正十二、二十一、二十五、二十八烷烃等直链烷烃,3,7-二甲基癸烷、3,5-二甲基十二烷、2-甲基十五烷、4-甲基十一烷等支链烷烃含量较高,6-甲基-2-吡嗪甲醇、丙醇、辛酯等酯醇类有机物含量较低。与产氢高峰期有机物转化类似,产甲烷高峰期相对活跃的微生物菌群使得煤结构中直链、支链烷烃及苯酚类物质脱落进入发酵液[15],使得发酵液COD值增大。甲酚上甲基发生羟基化反应生成对羟基苯甲醇或者对甲基苯甲醛,并进一步转化为对羟基苯甲酸和苯酚[16],乙苯首先被氧化为1-苯乙醇,并进一步氧化为芳香酮苯乙酮,在苯甲酰乙酰酶A的作用下苯乙酮通过羧化反应生成苯甲酰乙酸乙酯[17]。这一转化特征使得直链、支链烷烃、甲醇类、甲氧基乙酸辛酯、五氟丙酸非癸酯等有机物含量增加,苯酚类、乙酮类含量降低,并检测到三氯乙酸、十六烷基酯、4-溴苯甲醛、三氟乙酰基-鲸蜡烷、2,6,10,15-四甲基十七烷等新生有机物。
第18~21天,直链烷烃在生物酶作用下发生延胡索酸加成反应或羧化反应进一步合成脂肪酸,随后转化为丙酮酸[18-21],导致烷烃类有机物相对含量减少,且1,2,5-二氮唑-3-羧酸开始生成并逐步开始积累,使pH有所降低。
二甲胺、N,N-二甲基乙酰胺、N,2,3-三甲基-丁烯酰胺等酰胺类物质可能是由含氮氨基侧链与有机酸或者直连烷烃结合生成,酰胺类水解生成![]() 或者NH3,在经厌氧氨氧化菌所分泌的联氨脱氢酶作用下产生氮气[22-23]。甲烷形成第12 d时在发酵性细菌的作用下,含氮官能团及侧链从煤体中脱落,大量氨基侧链形成酰胺;对于生物标志化合物4-甲基芴,由于其相对稳定,在反应前期(第6天)未被转化,在反应高峰期被消耗并向着其他物质进行转化。
或者NH3,在经厌氧氨氧化菌所分泌的联氨脱氢酶作用下产生氮气[22-23]。甲烷形成第12 d时在发酵性细菌的作用下,含氮官能团及侧链从煤体中脱落,大量氨基侧链形成酰胺;对于生物标志化合物4-甲基芴,由于其相对稳定,在反应前期(第6天)未被转化,在反应高峰期被消耗并向着其他物质进行转化。
2.3.3 联产过程液相产物对比
研究表明,氢气-甲烷联产发酵有利于煤的资源化利用,可明显提升其能源转化率[24];联产发酵期间有机液相产物的变化研究对于理解其系统内部运行稳定性、产气代谢机理具有重要意义。基于此,系统总结分析了氢-甲烷联产过程中液相有机产物的变化特征(图7,表2),图7中红色虚线左侧为产氢阶段,右侧为产甲烷阶段。

图7 氢气-甲烷联产过程中液相有机物浓度变化
Fig.7 Characteristics of different liquid organic compounds concentration during the process of H2 and CH4 co-production
结果显示,氢气-甲烷联产过程中不同类型有机物浓度特征变化明显。产氢结束后发酵液内直链烷烃、支链烷烃浓度相对较低,分别为67.05,21.16 μg/mL(图7(a)),但对产甲烷水解限速阶段起到了类缓冲作用,为产甲烷阶段提供了有效利用体,使产甲烷发酵液出现了浓度更高、种类更多的直链、支链烷烃类有机物,最高可达216.63,112.28 μg/mL(图7(a))。
同时,产氢末期残留的大量丁酸、丙酸等挥发性脂肪酸(332.63 μg/mL)可被产甲烷过程的同型产乙酸菌和产甲烷菌有效利用,转化形成CH4,CO2等气体,致使甲烷发酵液内酸性有机物浓度较低,最低为6.75 μg/mL(图7(b))。难降解的大分子含氧、含氮有机物浓度则相对较低,分别为19.34,17.54 μg/mL(图7(c),(d))。
产氢过程对煤中大分子物质的有效降解及产甲烷过程菌群结构的复杂多样性,共同导致甲烷液相中N,N-二甲基乙硫胺,2,2,3,3,3-五氟丙酸十九烷基酯等含氮、含氧有机物浓度大量增加,最高分别为110.49,108.65 μg/mL,同时检测出包括环二十烷、3-已氧基丙腈、3-甲基-2,2-双甲氧基丙醇、腙和4-甲基芴等新生有机物(表2,图7(c),(d))。
表2 氢气-甲烷联产过程液相有机产物
Table 2 Organic liquid products during the process of H2and CH4 co-production

有机物类别相同有机物甲烷相新生有机物直链烷烃十二烷十六烷十七烷十九烷二十一烷二十五烷二十六烷二十八烷三十烷三十一烷二十四烷二十七烷支链烷烃2-氯甲基-1,3-二甲氧基丙烷3-乙基-3-甲基庚烷2,4,6-三甲基辛烷4,6-二甲基十二烷2,6,11-三甲基十二烷5-丙基十三烷5-丙基丙烷1,2,4-三甲氧基丁烷4-乙基癸烷2,6-二甲基癸烷3,6-二甲基癸烷3,7-二甲基癸烷2,3,5-三甲基癸烷2,4,6-三甲基癸烷2,3,7-三甲基癸烷4-甲基十一烷1,9-二甲基十一烷5,7-二甲基十一烷3,5-二甲基十二烷2-甲基十五烷2,6,10-三甲基十五烷三氟乙酰基-鲸蜡烷9-甲基十七烷10-甲基十九烷醇丁醇五氟丙酸八角甾醇6-甲基-2-吡嗪甲醇3-甲基-2,2-双甲氧基甲基丙醇5-甲基-2-吡嗪甲醇酸2-甲基丙酸非己烯酸丁酸1,2,5-二氮唑-3-羧酸含氧有机物2,4-二叔丁基苯酚2-甲基十一醛二氯乙酸-庚酯亚硫酸,十二丁基酯三氯乙酸十五烷基酯五氟丙酸十五烷基酯七氟丁酸十五烷基酯2,2,3,3,3-五氟丙酸十九烷基酯2,6-二(叔丁基)-4-羟基-4-甲基-2,5-环己二烯-1-酮3′,5′-二甲氧基苯乙酮2-叔丁基-4-羟基茴香醚4-丙基苯甲醛4-溴苯甲醛苯酚甲氧基乙酸辛酯亚硫酸,异戊基戊酯亚硫酸,3-甲基已基-十二烷基辛酯五氟丙酸非癸酯五氟丙酸十四烷基酯三氯乙酸十六烷基酯碳酸,异丁基十八酯碳酸,2,2,2-三氯乙基十八酯含氮有机物N,N-二甲基乙硫胺N,2,3-三甲基丁烯酰胺二甲胺N2-(4-羟基-6-甲基嘧啶-2-基)腙其他有机物—环二十烷—4-甲基芴
3 结 论
(1)联产期间氢气与甲烷最大产气量分别为66.29 μmol/g和55.78 μmol/g,各占氢气与甲烷总产气量的25.78%和25.47%。反应结束后底物转化率分别是2.4%和4.9%。
(2)煤发酵联产氢气-甲烷形成的有机中间体主要包括丁酸、丙酸等挥发性脂肪酸、烷烃(直链、支链烷烃)、醇(五氟丙酸八角甾醇、6-甲基-2-吡嗪甲醇、丁醇)、烯烃(十八碳烯、二十二烯等)、含氧有机物(酯类、乙酮、苯酚、苯甲醛等),含氮有机物(二甲胺、N,N-二甲基乙硫胺)、嘧啶类、吡嗪类杂环化合物。
(3)产甲烷阶段检测到更多的直链、支链烷烃、含氧、含氮大分子有机物及环烷烃、腈类、腙类、4-甲基芴等新生有机物。
(4)pH,COD与OD600的变化过程与关键有机中间液相产物的变化特征相一致,进一步反映了煤发酵联产的优越性,可为煤的发酵联产工艺参数调控、产气效率的提高提供借鉴。
[1] 王媛媛.猪粪两相厌氧发酵产氢-甲烷技术与试验研究[D].武汉:华中农业大学,2009.
WANG Yuanyuan.Technology and examination research of two-phase anaerobic fermentation to produce hydrogen and methane from pig manure[D].Wuhan:Huazhong Agricultural University,2009.
[2] YEOH B G.Two-phase anaerobic treatment of cane-molasses alcohol stillage[J].Water Science and Technology,1997,36(6-7):441-448.
[3] GHOSH S,HENRY M P,SAJJAD A,et al.Pilot-scale gasification of municipal solid wastes by high-rate and two-phase anaerobic digestion[J].Water Science & Technology,2000,41(3):101-110.
[4] SCHERER P A,VOLLMER G R,FAKHOURI T,et al.Development of a methanogenic process to degrade exhaustively the organic fraction of municipal “grey waste” under thermophilic and hyperthermophilic conditions[J].Water Science & Technology,2000,41(3):83-91.
[5] 苏现波,陈鑫,夏大平,等.煤发酵制生物氢和甲烷的模拟实验[J].天然气工业,2014,34(5):179-185.
SU Xianbo,CHEN Xin,XIA Daping,et al.An experimental study of hydrogen and methane production from fermentation of coal[J].Natural Gas Industry,2014,34(5):179-185.
[6] OREM W H,VOYTEK M A,JONES E J,et al.Organic intermediates in the anaerobic biodegradation of coal to methane under laboratory conditions[J].Organic Geochemistry,2010,41(9):997-1000.
[7] 夏大平.二价铁镍离子及组合对煤层生物甲烷生成的影响机理研究[D].焦作:河南理工大学,2017:53.
XIA Daping.Effects mechanism of Fe2+ and Ni2+ and their combinations on biogenic methane production of coal[D].Jiaozuo:Henan Polytechnic University,2017:53.
[8] 夏大平,司青,马俊强,等.煤发酵产氢条件及正交优化实验研究[J].煤炭转化,2014,37(3):72-76.
XIA Daping,SI Qing,MA Junqiang,et al.Experimental study on hydrogen production conditions of coal fermentation and orthogonal optimization[J].Coal Conversion,2014,37(3):72-76.
[9] GUO Hongyu,DONG Zhiwei,SU Xianbo,et al.Synergistic biodegradation of coal combined with corn straw as a substrate to methane and the prospects for its application[J].Energy & Fuels,2018,32(6):7011-7016.
[10] 洪江涛.煤制生物氢过程中各相态物质组成及转化研究[D].焦作:河南理工大学,2018:46.
HONG Jiangtao.The composition and transition of intermediates of different phases during the process of coal-to-biohydrogen fermentation[D].Jiaozuo:Henan Polytechnic University,2018:46.
[11] 任南琪.产酸发酵微生物生理生态学[M].北京:科学出版社,2005.
[12] 赵世敏.微生物发酵法生产2,3-丁二醇[D].无锡:江南大学,2008:2-3.
ZHAO Shimin.Production of 2,3-butanediol by fermentation[D].Wuxi:Jiangnan University,2008:2-3.
[13] 郭学武.肺炎克雷伯氏菌产2,3-丁二醇的代谢调控研究[D].天津:天津大学,2014:11.
GUO Xuewu.Metabolic Regulation of the synthesis of 2,3-butanediol in Klebsiella pneumoniae[D].Tianjin:Tianjin University,2014:11.
[14] 赵杰红,张波,蔡伟民.厌氧消化系统中丙酸积累及控制研究进展[J].中国给水排水,2005,21(3):25-27.
ZHAO Jiehong,ZHANG Bo,CAI Weimin.Research progress on propionic acid accumulation and control in anaerobic digestion system[J].China Water & Wastewater,2005,21(3):25-27.
[15] 张双全.煤化学(第二版).[M].徐州:中国矿业大学出版社,2009.
[16] TSAI J C,KUMAR Mathava,LIN J G.Anaerobic biotransformation of fluorene and phenanthrene by sulfate-reducing bacteria and identification of biotransformation pathway[J].Journal of Hazardous Materials,2009,164(2-3):847-855.
[17] JOHNSON H A,PELLETIER D A,SPORMANN A M.Isolation and characterization of anaerobic ethylbenzene dehydrogenase,a novel Mo-Fe-S enzyme[J].Journal of Bacteriology,2001,183(15):4536-4542.
[18] KROPP K G,DAVIDOVA I A,SUFLITA J M.Anaerobic oxidation of n-dodecane by an addition reaction in a sulfate-reducing bacterial enrichment culture[J].Applied and Environmental Microbiology,2000,66(12):5393-5398.
[19] ANDERSON R T,LOVLEY D R.Hexadecane decay by methanogenesis[J].Nature,2000,404(6779):722-723.
[20] CALLAGHAN A V,GIEG L M,KROPP K G,et al.Comparison of mechanism of alkane metabolism under sulfate-reducing conditions among two bacteria Isolates and a bacterial consortium[J].Applied and Environmental Microbiology,2006,72(6):4274-4282.
[21] RABUS R,WILKES H,BEHRENDS,A,et al.Anaerobic initial reaction on n-alkanes in a denitrifying bacterium:Evidence for(1-methylpentyl) succinate as initial product and for involvement of an organic radical in n-hexane metabolism[J].Journal of Bacteriology,2001,183(5):1707-1715.
[22] 郑平,胡宝兰.厌氧氨氧化菌混培物生长及代谢动力学研究[J].生物工程学报,2001,17(2):193-198.
ZHEN Ping,HU Baolan.Kinetics of anaerobic ammonia oxidation[J].Chinese Journal of Biotechnology,2001,17(2):193-198.
[23] 黄峰.氨氮降解菌的降解特性及其代谢产物的研究[D].太原:太原理工大学,2016:57.
HUANG Feng.Degradation characteristics of ammonium removal bacteria and the study of its metabolic products[D].Taiyuan:Taiyuan University of Technology,2016:57.
[24] 夏大平,陈曦,王闯,等.褐煤酸碱预处理-微生物气化联产H2-CH4的实验研究[J].煤炭学报,2017,42(12):3221-3228.
XIA Daping,CHEN Xi,WANG Chuang,et al.Experimental study on the production of H2-CH4 from lignite jointly with acid-alkali pretreatment-microbial gasification[J].Journal of China Coal Society,2017,42(12):3221-3228.
