
移动阅读
马双忱1,刘亚争1,马 岚1,吴 伟2,赵兴辉2,高 然1,林宸雨1
(1.华北电力大学 环境科学与工程系,河北 保定 071003; 2.华能沁北发电有限公司,河南 济源 450052)
摘 要:为制备镁铝摩尔比为4∶1的镁铝水滑石(LDH),实验采用共沉淀直接法,即在450 ℃温度下焙烧LDH 3 h,得到焙烧镁铝水滑石(CLHD)。取CLDH吸附剂于250 mL锥形瓶中,在一定条件下对5 000~20 000 mg/L高浓度Cl-模拟溶液及实际脱硫废水进行脱氯吸附实验和CLDH再生及重复使用性实验。探究了不同反应时间、初始浓度、反应温度、溶液的初始pH及CLDH的投加量对氯离子的脱除效果的影响,采用BET,XRD,FT-IR探究吸附机理。实验结果表明,CLHD吸附Cl-是由于层间阴离子可交换性(“结构记忆”),对Cl-吸附符合一级动力学模型,吸附量及脱氯率随反应时间的增大呈现出先快速增加后缓慢增加的趋势,吸附平衡后发生缓慢脱附反应;吸附等温线符合Freundlich方程模型,吸附量随Cl-初始浓度的增加而增大,最佳脱氯效果参数为Cl-浓度5 000 mg/L,之后随着氯离子浓度增大,由于吸附点位数量一定,脱氯率降低;CLDH对吸附Cl-的脱除率及吸附量随着温度的增加而增加,当反应温度为65 ℃时,脱氯率及吸附量最大,当温度继续升高,CLDH对Cl-的吸附效果大幅下降;改变pH值,CLDH对Cl-的吸附效果差别较小,但当pH=8时达到脱氯率及吸附量的最大值;随着CLDH投加量的增加,脱氯率逐渐变小,最佳投加量为8 g/L。65 ℃、pH=8时的实际脱硫废水脱氯实验中,CLDH脱氯率可达50.90%,一次煅烧再生CLDH脱氯率稍降,二次煅烧再生CLDH脱氯率降低约50%,CLDH对脱硫废水脱氯具可再生重复使用性。
关键词:焙烧镁铝水滑石;吸附;Cl-;脱硫废水
中图分类号:TQ028.8
文献标志码:A
文章编号:0253-9993(2019)02-0611-07
马双忱,刘亚争,马岚,等.焙烧镁铝水滑石吸附脱硫废水中高浓度Cl-的基础研究[J].煤炭学报,2019,44(2):611-617.doi:10.13225/j.cnki.jccs.2018.0548
MA Shuangchen,LIU Yazheng,MA Lan,et al.Adsorption and ion-exchange behavior of calcined Mg-Al layered double hy-droxide for high concentration Cl- from flue gas desulfurization wastewater[J].Journal of China Coal Society,2019,44(2):611-617.doi:10.13225/j.cnki.jccs.2018.0548
收稿日期:2018-04-23
修回日期:2018-10-15
责任编辑:常明然
基金项目:中央高校基本科研业务费专项资金资助项目(2016XS115)
作者简介:马双忱(1968—),男,辽宁大连人,教授,博士。Tel:0312-7525521,E-mail:msc1225@163.com
MA Shuangchen1,LIU Yazheng1,MA Lan1,WU Wei2,ZHAO Xinghui2,GAO Ran1,LIN Chenyu1
(1.College of Environmental Science and Engineering,North China Electric Power University (Baoding),Baoding 071003,China; 2.Qinbei Coal-fired Plant,Henan Province,Jiyuan 450052,China)
Abstract:In order to obtian the magnesium aluminum hydrotalcite (LDH) with a molar ratio of 4∶1 (magnesium:aluminum),the direct method of coprecipitation was used to calcine LDH at 450 ℃ for 3 h to obtain the calcined magnesium aluminum hydrotalcite (CLHD).The CLDH adsorbent was taken in a 250 mL Erlenmeyer flask.Under certain conditions,dechlorination adsorption experiments and CLDH regeneration and reusability experiments were carried out on 5 000-20 000 mg/L high concentration Cl- simulation solution and actual desulfurization wastewater.The effects of different reaction times,initial concentration,reaction temperature,initial pH of solution and dosage of CLDH on the removal of chloride ions were investigated.The adsorption mechanism was investigated by BET,XRD and FT-IR.The experimental results show that CLHD adsorbs Cl- due to interlayer anion exchangeability (“structural memory”),and Cl- adsorption conforms to the first-order kinetic model.The adsorption amount and dechlorination rate increase rapidly with the increase of reaction time.After the slow increase trend,the slow desorption reaction occurs after the adsorption equilibrium; the adsorption isotherm conforms to the Freundlich equation model,and the adsorption amount increases with the increase of the initial concentration of Cl-.The optimal dechlorination effect parameter is Cl- concentration 5 000 mg/L,then with the increase of chloride ion concentration,the dechlorination rate decreases due to the certain number of adsorption sites; the removal rate and adsorption capacity of CLDH for the adsorption of Cl- increase with the increase of temperature,when the reaction temperature is 65 ℃.The dechlorination rate and the adsorption amount are the largest.When the temperature continues to increase,the adsorption effect of CLDH on Cl- is greatly reduced.When the pH value is changed,the adsorption effect of CLDH on Cl- is small,but when the pH is 8,the dechlorination rate and the maximum amount of adsorption are reached.With the increase of CLDH dosage,the dechlorination rate gradually becomes smaller,and the optimal dosage is 8 g/L.In the dechlorination experiment of actual desulfurization wastewater at 65 ℃ and pH=8,the dechlorination rate of CLDH can reach 50.90%,the dechlorination rate of CLDH in one calcination is slightly decreased,and the dechlorination rate of CLDH in second calcination is reduced by about 50%.Desulfurization wastewater dechlorination has a reproducible reusability.
Key words:Mg-Al-CLDH;adsorption;Cl-;FGD wastewater
2015年《水污染防治行动计划》提出“狠抓工业污染防治”,一些重点地区禁止污水外排,电厂废水治理倍受关注。石灰石-石膏湿法烟气脱硫技术因其脱硫效率高,在超低排放改造后被火电厂广泛使用[1-2]。湿法脱硫循环运行过程中,脱硫浆液中氯离子不断富集,过量Cl-影响石灰石的溶解、降低石膏品质、导致设备的腐蚀加剧,为保证系统稳定可靠,控制Cl-浓度在10 000~20 000 mg/L外排脱硫废水[3]。脱硫废水作为终端废水水质恶劣,具有高氯、高硬度、高悬浮物、含重金属的特点,经过“中和、混凝、沉淀”的三联箱工艺处理后,重金属及悬浮物含量降低,但仍为高氯的含盐水且水量较大,2017年《火电厂污染防治可行性技术指南》(HJ2301—2017)指出实现废水近零排放的关键是实现脱硫废水零排放[4-6]。可以看出,脱硫废水中Cl-浓度是关键控制指标,若能降低脱硫废水的Cl-含量,可提高脱硫废水循环倍率,使得废水减量化,节约后续脱硫废水近零排放处理成本。
目前去除废水中氯离子的方法主要有电凝聚法、离子交换法、吸附法等[7]。吸附法具有固液分离、操作简单、成本低、效率高等优点,其中,水滑石(LDH)作为一种经济环保的吸附剂,在废水处理方面倍受关注[8]。水滑石又称层状双金属氢氧化物,是一种具有层状结构的阴离子黏土,化学表达式为Mg6A12(OH)16CO3·4H2O[9]。它的焙烧产物,焙烧水滑石(CLDH)的层状结构塌陷,若将CLDH放入到含有某些阴离子的环境中时,这些阴离子会插入到层间进而恢复LDHs原有的层状结构,即“记忆效应”[10]。利用这种独特的结构记忆效应CLDH可用作Cl-吸附剂。
目前利用焙烧镁铝水滑石吸附去除氯离子的研究取得良好进展,但多集中于Cl-为100~1 000 mg/L的低浓度研究[11-14],且对于实际脱硫废水的氯离子去除鲜有研究。因此,以脱硫废水为研究对象,系统研究了CLDH对高浓度5 000~20 000 mg/L Cl-的吸附特性,并进一步考察了在实际脱硫废水中的脱氯效果及吸附剂再生性能,为焙烧镁铝水滑石脱除脱硫废水中的Cl-提供参考。
本实验制备LDH采用分析纯(AR)试剂:Mg(NO3)2·6H2O,Al(NO3)3·9H2O,Na2CO3,NaOH。
本实验采用的废水为NaCl模拟废水及某电厂脱硫废水。模拟废水采用固体NaCl(AR)加入去离子水配制Cl-浓度为100~20 000 mg/L的溶液。脱硫废水为某电厂经“三联箱”处理后脱硫废水出水,送至北京理化测试中心检测,其主要化学成分见表1。
(1)CLDH的制备方法。
采用pH值共沉淀直接法、双滴法、高压反应釜法分别制备LDH,控制镁铝物质的量比为3∶1,4∶1,分别采用去离子水及蒸馏水进行制备实验,不同方法得到CLDH脱氯效果如图1所示。可以看出去离子水与蒸馏水去除效果相似,镁铝物质的量比为4∶1时脱除效果更佳,直接法制备吸附剂脱除效率略大于双滴法,高压反应釜法制备的吸附剂可提高脱除率约21%。但本文采用直接沉淀法制备水滑石,其操作简单、水滑石产量较大。
表1 某电厂“三联箱”处理后脱硫废水出水成分
Table 1 Compositions of FGD wastewater in a power plant

注:SS为固体悬浮物,TDS为可溶解性固体总量。

图1 不同制备方法的CLDH脱氯效果对比
Fig.1 CLDH dechlorination by different preparation methods
实验采用共沉淀直接法制备CLDH,具体如下:按镁铝物质的量比4∶1的比例称取Mg(NO3)2·6H2O,Al(NO3)3·9H2O,溶于去离子水得到混合盐溶液,按[OH-]=2([Mg2+]+[Al3+])和![]() 比例称取Na2CO3,NaOH,溶于去离子水得到混合碱溶液;将盐溶液与碱溶液迅速混合搅拌,控制溶液pH值为9.5,得到乳白色悬浊液;封口,65 ℃恒温晶化12 h,静置冷却后洗涤至中性,抽滤;滤饼于80 ℃下烘干,研磨,得到LDH;450 ℃温度下焙烧3 h,得到CLDH[15]。
比例称取Na2CO3,NaOH,溶于去离子水得到混合碱溶液;将盐溶液与碱溶液迅速混合搅拌,控制溶液pH值为9.5,得到乳白色悬浊液;封口,65 ℃恒温晶化12 h,静置冷却后洗涤至中性,抽滤;滤饼于80 ℃下烘干,研磨,得到LDH;450 ℃温度下焙烧3 h,得到CLDH[15]。
(2)CLDH吸附实验。
取CLDH吸附剂于250 mL锥形瓶中,加入Cl-溶液,一定温度下恒温水浴震荡4 h,震荡速度为200 r/min,然后抽滤,测定上清液Cl-的浓度。根据吸附前后Cl-的浓度变化,按式(1)计算脱氯率η,式(2)计算吸附量q[16]为
η=(c0-c)/c0(1)
式中,η为脱氯率,%;c0和c为吸附前后溶液中Cl-离子的浓度,mg/L。
qt(qe)=(c0-c)V/m(2)
式中,qt为吸附时间t时的吸附量,mg/g;qe为单位质量的最大吸附量,mg/g;V为溶液的体积,L;m为吸附剂质量,g。
每项实验设置两组平行实验,实验结果为其平均值。
(3)CLDH再生和重复使用性。
CLDH吸附脱硫废水中Cl-实验后,过滤、洗涤,滤饼80 ℃下烘干,后于450 ℃下焙烧3 h,得到再生吸附剂,重复操作。
(4)测定及表征方法。
Cl-浓度采用GB11869—89硝酸银滴定法测定。采用Quantatech Co Auto-sorb-iQA3200-4型进行BET比表面积测试。采用Buker D8advance型X射线衍射仪(XRD)确定水滑石物相,XRD扫描范围为5°~90°,扫描速度为4°/min,X射线管工作工作电压为30 kV,管流为20 mA。采用美国Perkin Elmer Spectrum 100型傅立叶变换红外光谱仪(FT-IR)进行红外分析,波数400~4 000 cm-1。
CLDH投加量为2 g/L时、温度25 ℃时,吸附时间0~9 h时CLDH吸附Cl-的结果,如图2所示。从图2可以看出,随反应时间的增大,吸附量及脱氯率先快速增加后缓慢增加,吸附平衡后发生缓慢脱附反应。图中在Cl-的吸附平衡时间为4 h,Cl-浓度为10 000 mg/L溶液中CLDH平衡吸附量为373.91 mg/g,Cl-浓度为15 000 mg/L溶液中CLDH平衡吸附量为539.68 mg/g。

图2 反应时间对CLDH吸附Cl-的影响
Fig.2 Effects of contact time on adsorption of Cl- by CLDH
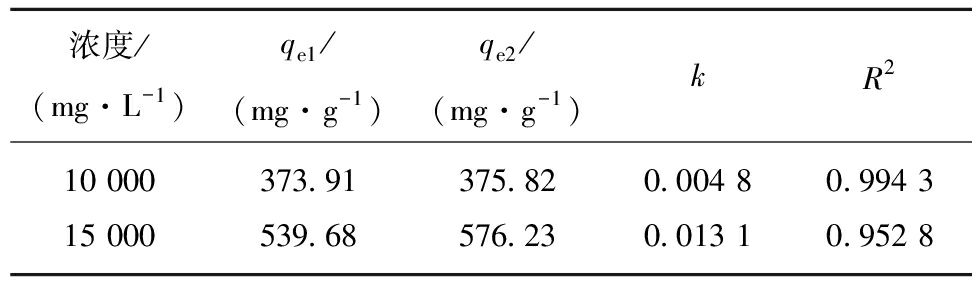
按一级动力学方程ln(qe1-qt)=ln qe2-kt对图2实验数据进行拟合,其中qe1为实验值,qe2为理论值,以ln(qe-qt)对t作图[17]得到图3,根据斜率和截距得到25 ℃下的动力学参数qe2和k,见表2。图3中相关性系数R2>0.95,表2中理论值与实际值接近,说明CLDH吸附Cl-符合一级动力学模型。

图3 CLDH吸附Cl-的一级动力学方程拟合
Fig.3 First-order kinetic model of adsorption of Cl- by CLDH
表2 CLDH吸附Cl-的一级动力学参数
Table 2 Kinetic parameters of adsorption of Cl- by CLDH
CLDH投加量为2 g/L时、温度25 ℃时,改变Cl-初始浓度100~20 000 mg/L对Cl-的吸附规律,如图4所示。由图4可以看出,平衡吸附量随着Cl-浓度提高而增大,但脱氯率在Cl-浓度为5 000 mg/L时最大,之后随着氯离子浓度增大,由于吸附点位数量一定,脱氯率降低。

图4 Cl-初始浓度对CLDH吸附Cl-的影响
Fig.4 Effects of initial concentration of Cl- on adsorption of Cl- by CLDH
按Freundlich等温方程![]() qe=ln K+ln ce/n)其中,ce为初始浓度,对图4实验数据进行拟合,以ln qe对ln ce作图[18]得到图5,根据斜率和截距得到25 ℃下的Freundlich常数K和1/n:K为0.049 3,1/n为0.969 6。1/n不在0.1~0.5,说明25 ℃下CLDH对高浓度Cl-并不易吸附,与脱氯率较低结果一致。图5拟合相关性系数R2>0.99,说明CLDH吸附Cl-等温线符合Freundlich等温方程模型。
qe=ln K+ln ce/n)其中,ce为初始浓度,对图4实验数据进行拟合,以ln qe对ln ce作图[18]得到图5,根据斜率和截距得到25 ℃下的Freundlich常数K和1/n:K为0.049 3,1/n为0.969 6。1/n不在0.1~0.5,说明25 ℃下CLDH对高浓度Cl-并不易吸附,与脱氯率较低结果一致。图5拟合相关性系数R2>0.99,说明CLDH吸附Cl-等温线符合Freundlich等温方程模型。

图5 CLDH吸附Cl-的Freundlich等温方程拟合
Fig.5 Adsorption isotherm of Cl- by CLDH
CLDH投加量为2 g/L时,改变反应温度35~85 ℃对吸附Cl-的影响,如图6所示。由图6可知随着温度的增加,CLDH对吸附Cl-的脱除率及吸附量增加,当达到65 ℃时,脱氯率及吸附量最大,当温度继续升高,CLDH对Cl-的吸附效果大幅下降。这是因为CLDH的表面吸附及离子交换吸附是吸热反应,提高温度加快反应进行,但过高温度破坏了吸附剂部分晶体结构,降低吸附性能[19]。

图6 反应温度对CLDH吸附Cl-的影响
Fig.6 Effects of temperature on adsorption of Cl- by CLDH
CLDH投加量为2 g/L时、温度25 ℃时,改变溶液初始pH值2~12对吸附Cl-的影响,如图7所示。可以看出改变pH值,CLDH对Cl-的吸附效果差别较小,但当pH=8时达到脱氯率及吸附量的最大值,4<pH<10时,吸附效果较差。这可能因为CLDH呈碱性,在强酸性环境中,CLDH溶解破坏结构,在强碱性环境中,阴离子OH-发生竞争吸附,与部分吸附点位结合,因此降低吸附性能[20]。

图7 溶液初始pH对CLDH吸附Cl-的影响
Fig.7 Effects of initial pH on adsorption of Cl- by CLDH
温度25 ℃时,改变CLDH投加量2~40 g/L对吸附Cl-的影响,如图8所示。由图8可知随着CLDH投加量的增加,脱氯率从18.8%递增到50.6%,吸附量从374.2 mg/g递减到75.8 mg/g;两曲线相交于8 g/L处,此时脱氯率及吸附量均较高,脱氯率为28.5%,吸附量为142.6 mg/g。可以看出,增加吸附量可提高脱氯效率,但吸附剂的吸附量则逐渐降低,最佳投加量为8 g/L。这是因为随着CLDH投加量增大,吸附点位增多,吸附Cl-的量增大,故脱氯率升高,但单位质量吸附剂的脱氯量减少,故吸附量降低。

图8 投加量对CLDH吸附Cl-的影响
Fig.8 Effects of dosage on adsorption of Cl- by CLDH
CLDH投加量为2 g/L时、温度65 ℃、pH=8时,CLDH对脱硫废水实际体系中浓度为18 640 mg/L的Cl-随时间的脱除率及吸附量变化,如图9所示。由图9可以看出,在最佳反应温度及最佳pH条件下,CLDH对成分复杂的脱硫废水中的Cl-有较好的吸附效果,在180 min时达到吸附平衡,脱氯率达50.90%,吸附量为1 866.6 mg/g。由表3看出,一次再生脱氯率为46.15%,是原始脱除效率的90.70%,二次再生脱氯率为29.00%,是原始脱除效率的56.90%。说明直接煅烧再生的CLDH,对于脱硫废水脱氯具可再生重复使用性,一次重复再生基本恢复吸附容量,二次重复再生脱除效率降低一半。

图9 CLDH对脱硫废水中Cl-的吸附
Fig.9 Adsorption of CLDH for Cl- of FGD wastewater
表3 CLDH吸附脱硫废水中Cl-的再生重复使用
Table 3 Regeneration of CLDH after adsorption of Cl- from FGD wastewater

2.7.1 BET比表面积分析
以BET法测算CLDH吸附剂的比表面积为48.8 m2/g,空隙容积为0.218 cm3/g,与以物理吸附为主的活性炭相比,其比表面积高达为500~5 000 m2/g,空隙容积为0.25~0.90 cm3/g,由此可以看出CLDH吸附原理不是以表面吸附为主,而是由于LDH结构的记忆效应,这与文献[10]结论一致。
2.7.2 XRD衍射分析
图10为CLHD不同的Cl-吸附实验前后XRD谱图。5~7号图谱在2θ为43.30°,62.56°处出现明显的CLHD的镁铝氧化物的特征衍射峰[22-24]。5号图谱基线平稳无杂峰,衍射峰对称性好,说明制备的CLHD纯度及结晶度较高,6~7号图谱说明煅烧再生使吸附剂恢复原来的层状结构。2θ为43.30°处峰高209(5号)>204(6号)>154(7号),2θ为62.56°处峰高104(5号)>96(6号)>64(7号),5~7号峰形变宽、强度减弱,说明再生CLHD结晶度降低,部分结构未恢复,因此未再生CLHD脱氯效率最大,二次再生CLHD脱氯效率最低。

图10 不同CLDH的XRD谱
Fig.10 XRD patterns of different CLDH
1—温度65 ℃下吸附实验后的CLHD;2—pH=8.06时吸附实验后的CLHD;3—pH=4.14时吸附实验后的CLHD;4—pH=12.00时吸附实验后的CLHD;5—镁铝物质的量比4∶1的CLHD;6—脱硫废水吸附实验后一次再生的CLHD;7—脱硫废水吸附实验后二次再生的CLHD
1~4号图谱在2θ为11.20°,22.65°,34.30°处出现了明显的LHD的特征衍射峰[21],CLHD说明吸附Cl-后,部分恢复了LHD的层状结构,结合BET比表面积测试结果,CLHD的吸附Cl-机理主要为层间阴离子的交换,即“记忆效应”。2~4号峰型相似,均是在改变pH条件吸附实验,说明改变pH对脱氯效果影响较小,而1号在最佳反应温度下的吸附后的CLHD图谱特征峰比2~4号的更窄更高,说明吸附更多Cl-、恢复LHD的层状结构更好,因此最佳温度下脱氯效率更好,同实验结果一致。

图11 不同CLDH的FT-IR谱
Fig.11 FT-IR spectra of different CLDH
2.7.3 FT-IR红外光谱分析
图11为CLHD不同的Cl-吸附实验前后FT-IR谱图。1~4号图谱中3 469 cm-1处的峰归属于羟基的伸缩振动,1 641 cm-1处的峰归属于羟基的弯曲振动[25],1 384 cm-1处的峰归属于层间![]() 的伸缩振动,656 cm-1处的峰归属于层间CO32-弯曲振动[26],400~800 cm-1处的峰归属于层间金属氧键的骨架振动[10],以上均为LHD的特征峰。说明吸附机理为CLHD吸附Cl-后,结构恢复为LHD。其中,
的伸缩振动,656 cm-1处的峰归属于层间CO32-弯曲振动[26],400~800 cm-1处的峰归属于层间金属氧键的骨架振动[10],以上均为LHD的特征峰。说明吸附机理为CLHD吸附Cl-后,结构恢复为LHD。其中,![]() 弯曲振动峰发生蓝移,这主要是氯离子进入层间与碳酸根的相互作用引起的[13]。此外,4号羟基的伸缩振动峰减弱,说明强碱环境破坏了CLHD的结构,因此pH=12实验中脱氯效率较低。
弯曲振动峰发生蓝移,这主要是氯离子进入层间与碳酸根的相互作用引起的[13]。此外,4号羟基的伸缩振动峰减弱,说明强碱环境破坏了CLHD的结构,因此pH=12实验中脱氯效率较低。
5~7号图谱中以上特征峰仍然存在,但羟基的伸缩振动、弯曲振动和碳酸根的吸收振动峰减弱,说明部分CO32-部分转化为CO2气体[27-28]。6~7号碳酸根的弯曲振动较5号发生了红移,这可能是氯离子进入层间与碳酸根的相互作用引起的。
(1)发现CLHD对Cl-吸附符合一级动力学模型,吸附等温线符合Freundlich方程模型。吸附平衡时间在4 h;吸附量随Cl-初始浓度的增加而增大,脱氯率在5 000 mg/L浓度Cl-时最大;随着反应温度的升高脱氯效果明显提高,但当温度超过65 ℃时,吸附效果大幅度降低;溶液pH值对吸附效果影响较弱,pH=8时,脱氯效果最佳;随着投加量增大,吸附量降低,脱氯率增大,最佳投加量为8 g/L。
(2)在CLDH投加量为2 g/L时、最佳反应温度65 ℃、最佳pH为8时,CLDH对脱硫废水中Cl-脱除率达50.90%,吸附量为1 866.6 mg/g;直接煅烧再生的CLDH对脱硫废水脱氯具有可再生重复使用性,一次再生脱氯率为46.15%,二次再生脱氯率为29.00%。
(3)通过BET,XRD,FT-IR表征分析,CLDH的主要吸附机理不是表面吸附,而是层间阴离子被Cl-取代,恢复了LDH的层间结构,即“结构记忆”机理。吸附脱硫废水后重复再生的吸附剂仍具有CLDH结构。
参考文献
[1] 马双忱,于伟静,贾绍广,等.燃煤电厂脱硫废水处理技术研究与应用进展[J].化工进展,2016,35(1):255-262.
MA Shuangchen,YU Weijing,JIA Shaoguang,et al.Research and application progresses of flue gas desulfurization (FGD) wastewater treatment technologies in coal-fired plants[J].Chemical Industry and Engineering Progress,2016,35(1):255-262.
[2] DOU Weixiao,ZHOU Zhen,YE Jiongjiong,et al.Reusing effluent of flue gas desulfurization wastewater treatment process as an economical calcium source for phosphorus removal[J].Water Science & Technology,2017,76(6):1429-1435.
[3] 于伟静.脱硫废水蒸发处理系统研究[D].北京:华北电力大学,2016.
YU Weijing.Study on FGD wastewater evaporation treatment[D].Beijing:North China Electric Power University,2016.
[4] DENG J J,PAN L M,CHEN D Q,et al.Numerical simulation and field test study of desulfurization wastewater evaporation treatment through flue gas[J].Water Science & Technology,2014,70(7):1285-1291.
[5] JIANG D N,SHA H W,GONG G H,et al.Fundamental research and demonstration project of evaporation treatment of wastewater from FGD in flue gas duct[J].Advanced Materials Research,2013(4):864-867.
[6] MA S,CHAI J,CHEN G,et al.Research on desulfurization wast-ewater evaporation:Present and future perspectives[J].Renewable & Sustainable Energy Reviews,2016(58):1143-1151.
[7] 公新忠,丁德馨,李广悦,等.含氟离子和氯离子酸性废水处理技术[J].环境工程学报,2012,6(9):3157-3160.
GONG Xinzhong,DING Dexin,LI Guangyue,et al.A treatment method for fluorine ion and chlorine ion-containing wastewater[J].Chinese Journal of Environmental Engineering,2012,6(9):3157-3160.
[8] THEISS F L,COUPERTHWAITE S J,AYOKO G A,et al.A review of the removal of anions and oxyanions of the halogen elements from aqueous solution by layered double hydroxides[J].Journal of Colloid & Interface Science,2014,417:356-368.
[9] LU L,HE J,WEI M,et al.Factors influencing the removal of fluoride from aqueous solution by calcined Mg-Al-CO3 layered double hydroxides[J].Journal of Hazardous Materials,2006,133(1-3):119-128.
[10] CAVANI F,Trifirò F,et al.Hydrotalcite-type anionic clays:Preparation,properties and applications[J].Catalysis Today,1991,11(2):173-301.
[11] BARRIGA C,GAITáN M,PAVLOVIC I,et al.Hydrotalcites as sorbent for 2,4,6-trinitrophenol:Influence of the layer composition and interlayer anion[J].Journal of Material Chemistry,2002,12(4):1027-1034.
[12] 胡静.焙烧镁铝碳酸根水滑石在含氯废水处理中的应用基础研究[D].杭州:浙江大学,2005.
HU Jing.Basic research on the application of calcined Mg-Al-CO3 layered double hydroxides in the treatment of chlorinated wastewater[D].Hangzhou:Zhejiang University,2005.
[13] 吕亮.层状双金属(氢)氧化物对卤离子的吸附和离子交换性能研究[D].北京:北京化工大学,2005.
LÜ Liang.Adsorption and ion-exehange behavior of layered double hydroxides in the uptake of halide anions from aqueous solution[D].Beijing:Beijing University of Chemical Technology,2005.
[14] 李春艳,蒋云福,赵俊,等.焙烧镁铝水滑石的制备及其对水中Cl-和![]() 的吸附特性[J].环境工程学报,2016,10(4):1719-1726.
的吸附特性[J].环境工程学报,2016,10(4):1719-1726.
LI Chunyan,JIANG Yunfu,ZHAO Jun,et al.Synthesis of calcinations modified Mg-Al hydrotalcite and its adsorption properties for Cl- and ![]() in water[J].Chinese Journal of Environmental Engineering,2016,10(4):1719-1726.
in water[J].Chinese Journal of Environmental Engineering,2016,10(4):1719-1726.
[15] AHMED I M,GASSER M S.Adsorption study of anionic reactive dye from aqueous solution to Mg-Fe-CO3 layered double hydroxide (LDH)[J].Applied Surface Science,2012,259(42):650-656.
[16] KAMEDA T,OBA J,YOSHIOKA T.Recyclable Mg-Al layered double hydroxides for fluoride removal:Kinetic and equilibrium studies[J].Journal of Hazardous Materials,2015(300):475-482.
[17] MA W,LÜ T,SONG X,et al.Characteristics of selective fluoride adsorption by biocarbon-Mg/Al layered double hydroxides composites from protein solutions:Kinetics and equilibrium isotherms study[J].Journal of Hazardous Materials,2014(268):166-176.
[18] KAMEDA T,OBA J,YOSHIOKA T.New treatment method for boron in aqueous solutions using Mg-Al layered double hydroxide:Kinetics and equilibrium studies[J].Journal of Hazardous Materials,2015(293):54-63.
[19] MANDAL S,TRIPATHY S,PADHI T,et al,Removal efficiency of fluoride by novel Mg-Cr-Cl layered double hydroxide by batch process from water[J].Environmental.Science,2013(25):993-1000.
[20] 近藤精一,石川达雄,安部郁夫,等.吸附科学[M].北京:化学工业出版社,2006.
[21] 王军锋,李子荣,郭雨.Mg/Al 型水滑石及其焙烧产物对水溶液中Cl-的吸附[J].西安工程大学学报,2008,22(2):171-174.
WANG Junfeng,LI Zirong,GUO Yu.Adsorption of chloride anion by Mg/Al hydrotalcite and its calcined product[J].Journal of Xi’ an Polytechnic University.2008,22(2):171-174.
[22] OGAWA M,KAUHO H.Homogeneous precipitation of uniform hydrotalcite particles[J].Langmuir,2002,18(11):4240-4242.
[23] ADACHI-PAGANO M,FORANO C,BESSE J P.Synthesis of Alrich hydrotalcite-like compounds by using the urea hydrolysis reaction-control of size and morphology[J].Journal of Materials Chemistry,2003,13(8):1988-1993.
[24] LAZARIDIS N K,PANDI T A,MATIS K A.Chromium (VI) removal from aqueous solutions by Mg-Al-CO3 hydrotalcite:Sorption-desorption kinetic and equilibrium studies[J].Industrial & Engineering Chemistry Research,2004,43(9):2209-2215.
[25] 夏燕,朱润良,陶奇,等.阴离子表面活性剂改性水滑石吸附硝基苯的特性研究[J].环境科学.2013,34(1):226-230.
XIA Yan,ZHU Runliang,TAO Qi,et al.Sorption of nitrobenzene to anionic surfactant modified layered double hydroxides[J].Environment Science.2013,34(1):226-230.
[26] YANG Weishen,KIM Y,LIU P K T,et al.A study by in situ techniques of the thermal evolution of the structure of a Mg-Al-CO3 layered double hydroxide[J].Chemical Engineering Science,2002,57(15):2945-2953.
[27] 申震,唐先进,刘超,等.焙烧态镁铝水滑石处理阴离子染料废水研究[J].环境科学与技术,2006,29(3):89-91.
SHEN Zhen,TANG Xianjin,LIU Chao,et al.Experimental study of treating anion dyestuff-containing wastewater by calcined layered double hydroxide[J].Environmental Science & Technology,2006,29(3):89-91.
[28] 郭亚祺,杨洋,伍新花,等.煅烧的水滑石同时去除水体中砷和氟[J].环境工程学报,2014,8(6):2485-2491.
GUO Yaqi,YANG Yang,WU Xinhua,et al.Removal of arsenate and fluoride in water by calcined layered double hydroxides[J].Chinese Journal of Environmental Engineering,2014,8(6):2485-2491.